CONCEPTOS BÁSICOS
Materia: Material físico del universo.
Átomos: Partículas infinitesimales con los que se construye la materia. Cada elemento se compone de un solo tipo de átomos. Los átomos se combinan en formas específicas para formar moléculas.
ESTADOS DE LA MATERIA
Una muestra de materia puede ser gaseosa, líquida o sólida. Estos se denominan estados de la materia y difieren en algunas de sus propiedades observables
Gas: No posee volumen ni forma definidos; se ajusta al volumen y la forma del recipiente que lo contiene. Puede comprimirse de modo que ocupe un volumen menor, o expandirlo para ocupar uno mayor. Presentan moléculas muy separadas que se mueven a altas velocidades.
Líquido*: Tiene un volumen definido, pero no tiene forma específica; asume la forma de la porción del recipiente que ocupa. Sus moléculas son más cercanas que en gases, pero se mueven rápidamente.
Sólido*: Posee tanto forma como volumen definidos; además es rígido, pues las moléculas están firmemente unidas entre sí.
*Ni los líquidos ni los sólidos pueden comprimirse de forma apreciable.

LEY DE LAS PROPORCIONES DEFINIDAS (LEY DE COMPOSICIÓN CONSTANTE)
"La composición elemental de un compuesto siempre es la misma".
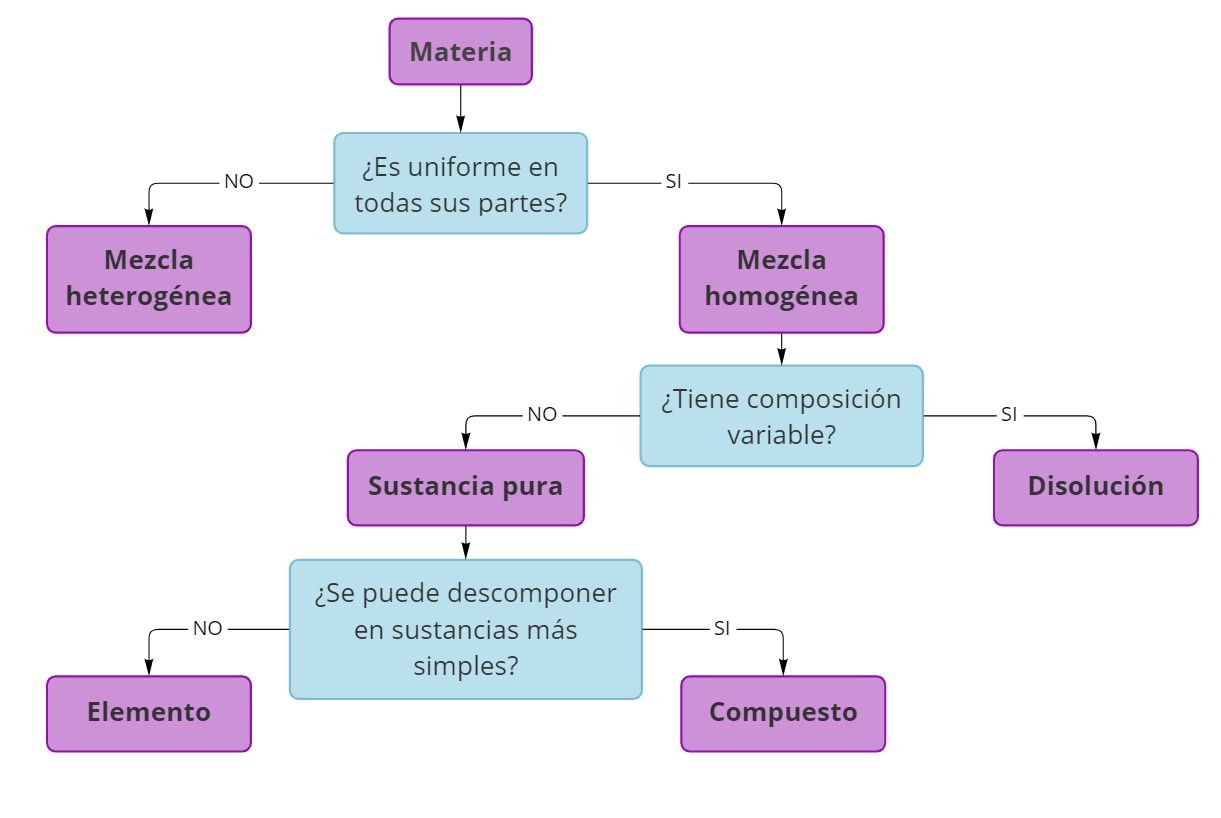
CLASIFICACIÓN DE LA MATERIA
La materia puede clasificarse en Sustancias Puras (compuestos o elementos) o en Mezclas (homogéneas o heterogéneas).
SUSTANCIAS PURAS
Materia que tiene propiedades definidas y una composición que no varía de una muestra a otra, pueden ser elementos o compuestos, poseen fómula química.
Elementos: sustancias que se combinan para formar la materia, no pueden descomponerse en sustancias más simples. Ejemplos: hidrógeno gaseoso (H2), metales como oro (Au), platino (Pt), mercurio (Hg), cloro gaseoso (Cl2) y oxígeno (O2).
Compuestos: Sustancias que contienen dos o más elementos. Ejemplos agua (H2O), ácido sulfúrico (H2SO4), hidróxido de sodio (NaOH), cloruro de litio (LiCl) y etanol (CH3CH2OH).
MEZCLAS
Son combinaciones de dos o más sustancias en las que cada una mantiene su propia identidad química. Su composición es variada.
Mezclas homogéneas: Mezclas uniformes en todos sus puntos, se conocen como disoluciones. Ejemplos: agua con azúcar, agua con etanol, amalgamas dentales, acero, bronce, aire y vino.
Mezclas heterogéneas: Mezclas con diferente composición, propiedades y apariencia en todos sus puntos. Ejemplos: agua de mar, concreto y sopa.
PROPIEDADES DE LA MATERIA
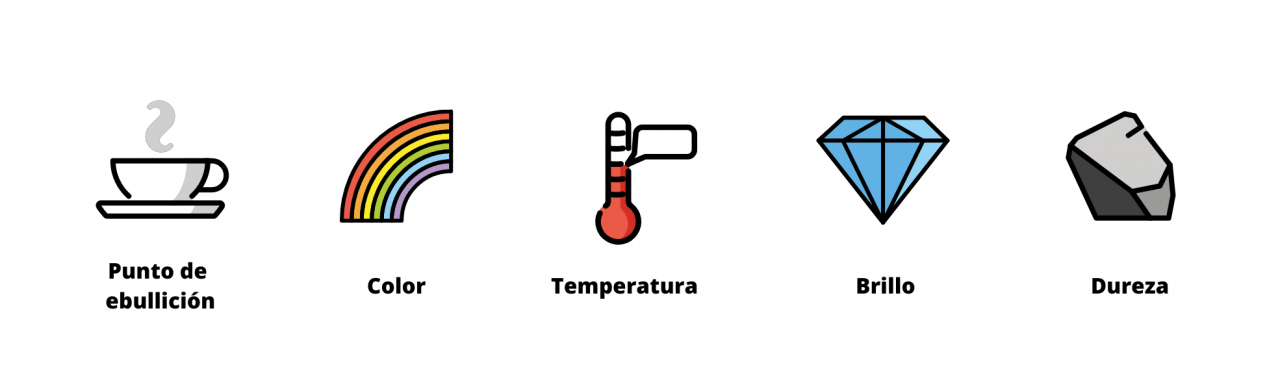
Cada sustancia tiene un conjunto único de propiedades: características que permiten reconocerla y distinguirla de otras sustancias. Se pueden clasificar en propiedades físicas o químicas, así como en propiedades intensivas o extensivas.
Propiedades físicas: se observan sin alterar la identidad y composición de la sustancia. Ejemplos: color, olor, densidad, punto de fusión, punto de ebullición y dureza.
Propiedades químicas: describen la forma en que una sustancia puede cambiar o reaccionar para formar otras sustancias, por ejemplo: la inflamabilidad y la combustión.
Propiedades intensivas: Tipo de propiedades que no dependen de la cantidad de muestra.
Propiedades extensivas: Tipo de propiedades que si dependen de la cantidad de muestra.
TIPOS DE CAMBIOS
Cambio físico: Se presenta cuando una sustancia cambia su apariencia física pero no su composición.

Cambio químico (Reacción química): Se presenta cuando una sustancia se transforma en otra químicamente diferente.