CONCEPTOS BÁSICOS
Energía: Es la capacidad para realizar o para transferir calor, sus unidades son los Julios (J).
Trabajo (W): Es la energía utilizada para mover un objeto contra una fuerza. Su fórmula es W = fuerza x distancia.
Calor (q): Es la energía empleada para incrementar una temperatura de un objeto. Se transfiere de un objeto más caliente hacia uno más frío.
ΔE = W + q
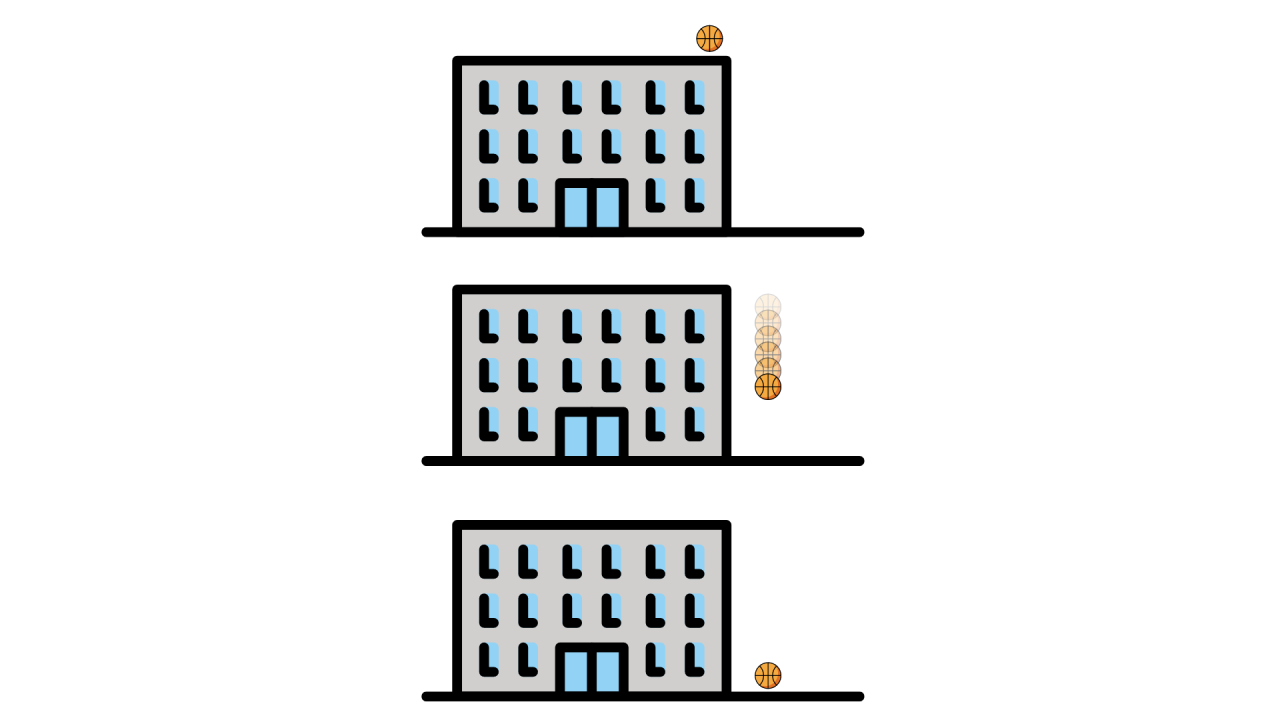
Energía cinética: Energía de movimiento dada por la fórmula Ek = ½ · m · v2 donde m es la masa y v es la velocidad del objeto.
Energía potencial: Energía en virtud de la posición de un objeto con respecto a otros objetos, dada por la fórmula Ep = g · m · h donde m es la masa, h es la altura relativa respecto al suelo y g es la constante gravitacional 9,8 m/s2.
Energía Interna (E): Suma de todas las energías cinéticas y potenciales de los componentes del sistema.
SISTEMA Y SU ENTORNO
Sistema: Parte limitada y bien definida del universo escogida para su estudio.
Entorno: Resto del universo.
En una reacción química los reactivos y los productos constituyen el sistema, el recipiente y todo lo demás se considera su entorno.
TIPOS DE SISTEMAS
Sistema abierto: Sistema donde la materia y la energía se pueden intercambiar con el entorno.
Sistema cerrado: Sistema en el que hay intercambio de energía, pero no de materia.
Sistema aislado: no hay intercambio de energía ni de materia con el entorno.
Sistema Adiabático: Sistemas que conservan la temperatura en periodo de tiempo corto, pueden intercambiar materia.

TRANSFERENCIA DE ENERGÍA (TRABAJO Y CALOR)
Primera Ley de la Termodinámica: “Cualquier energía perdida por un sistema debe ganarla su entorno y viceversa”.
Cambio en la energía interna: ΔE = Efinal - Einicial
ΔE = q + W
ΔE > 0 cuando Efinal > Einicial significa que el sistema ganó energía de su entorno.
ΔE < 0 cuando Efinal < Einicial significa que el sistema perdió energía de su entorno.
Cuando se añade calor a un sistema o se realiza un trabajo sobre éste, su energía interna aumenta.
Cuando el entorno transfiere calor al sistema, q tiene un valor positivo.
Cuando el entorno realiza un trabajo sobre el sistema W tiene un valor positivo.
La pérdida de calor del sistema hacia el entorno, así como el trabajo realizado por el sistema sobre el entorno, tienen valores negativos, disminuyen la energía interna del sistema.
Proceso endotérmico: El sistema absorbe calor de su entorno.
Proceso exotérmico: El sisitema pierde calor y lo libera a su entorno.

Función de estado: Una propiedad de un sistema que se determina especificando la condición o el estado de un sistema (Temperatura, Presión u otros factores). El valor de una función de estado solo depende del estado actual de un sistema, no de la trayectoria que el sistema siguió para llegar a dicho estado. Solo depende de los estados inicial y final. La energía es función de estado, el calor y el trabajo NO son funciones de estado.

Temperatura: Medida del calor o frío de un objeto, propiedad física que determina la dirección del flujo de calor. El calor siempre fluye de una sustancia que se encuentra a mayor temperatura hacia otra de menor temperatura.
ESCALAS DE TEMPERATURA
Celsius (°C): Punto de fusión del agua 0 °C, punto de ebullición del agua 100 °C.
Kelvin (K): 0 K se conoce como cero absoluto. La fórmula para convertir desde grados Celsius a grados Kelvin se ve modelada de la siguiente manera K = °C + 273,15.
Fahrenheit (°F): °F = 9⁄5 · °C + 32.