EL ÁTOMO
Según la teoría atómica de Dalton, los átomos son las partículas más pequeñas de un elemento que conservan la identidad química del elemento.
- Cada elemento se compone de partículas extremadamente pequeñas llamadas átomos.
- Todos los átomos de un elemento dado son idénticos; los átomos de elementos diferentes son diferentes y tienen propiedades distintas (incluida la masa).
- Los átomos de un elemento no se transforman en átomos diferentes durante las reacciones químicas; los átomos no se crean ni se destruyen en las reacciones químicas.
- Cuando se combinan átomos de más de un elemento se forman compuestos; un compuesto dado siempre tiene el mismo número relativo de la misma clase de átomos.
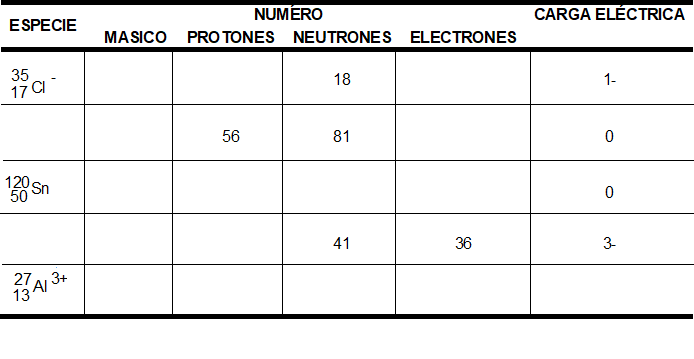
En una visión muy sencilla del átomo sólo tres partículas subatómicas ⎯el protón, el neutrón y el electrón⎯ afectan el comportamiento químico.
La carga de un electrón es -1.602 x 10-19 C, y la de un protón, 1.602 x 10-19 C. Por comodidad, las cargas de las partículas atómicas y subatómicas se pueden expresar como múltiplos de esta carga, y no en coulomb. Así pues, la carga del electrón es 1-, y la del protón, 1+. Los neutrones no están cargados; es decir, son eléctricamente neutros. Los átomos tienen números iguales de protones y de electrones, así que no tienen carga eléctrica neta.
Los protones y los neutrones están en el núcleo del átomo que es extremadamente pequeño. Prácticamente todo el volumen de un átomo es el espacio en el que residen los electrones llamada periferia o nube electrónica. Los electrones son atraídos hacia los protones del núcleo por la fuerza que existe entre partículas con carga eléctrica opuesta.
Comparación del protón, el neutrón y el electrón
Todos los átomos se componen de protones, neutrones y electrones. Puesto que estas partículas son las mismas en todos los átomos, la diferencia entre átomos de distintos elementos (oro y oxígeno, por ejemplo) se debe exclusivamente a la diferencia en el número de partículas subatómicas contenidas en cada átomo.
La tabla periódica es una organización de los elementos en orden de número atómico creciente. Los elementos con propiedades similares se colocan en columnas verticales. Los elementos de una columna forman un periodo. Los elementos metálicos, que comprenden la mayor parte de los elementos, dominan el lado izquierdo y la parte media de la tabla; los elementos no metálicos se encuentran
en la parte superior derecha. Varios de los elementos adyacentes a la línea que separa los metales de los no metales son los llamados metaloides. Los elementos pueden clasificarse por número atómico o número de protones, además de poseer un número de masa de un átomo es la suma de los números de protones y de neutrones. Esta información la encontramos en la tabla periódica y se explica a continuación.
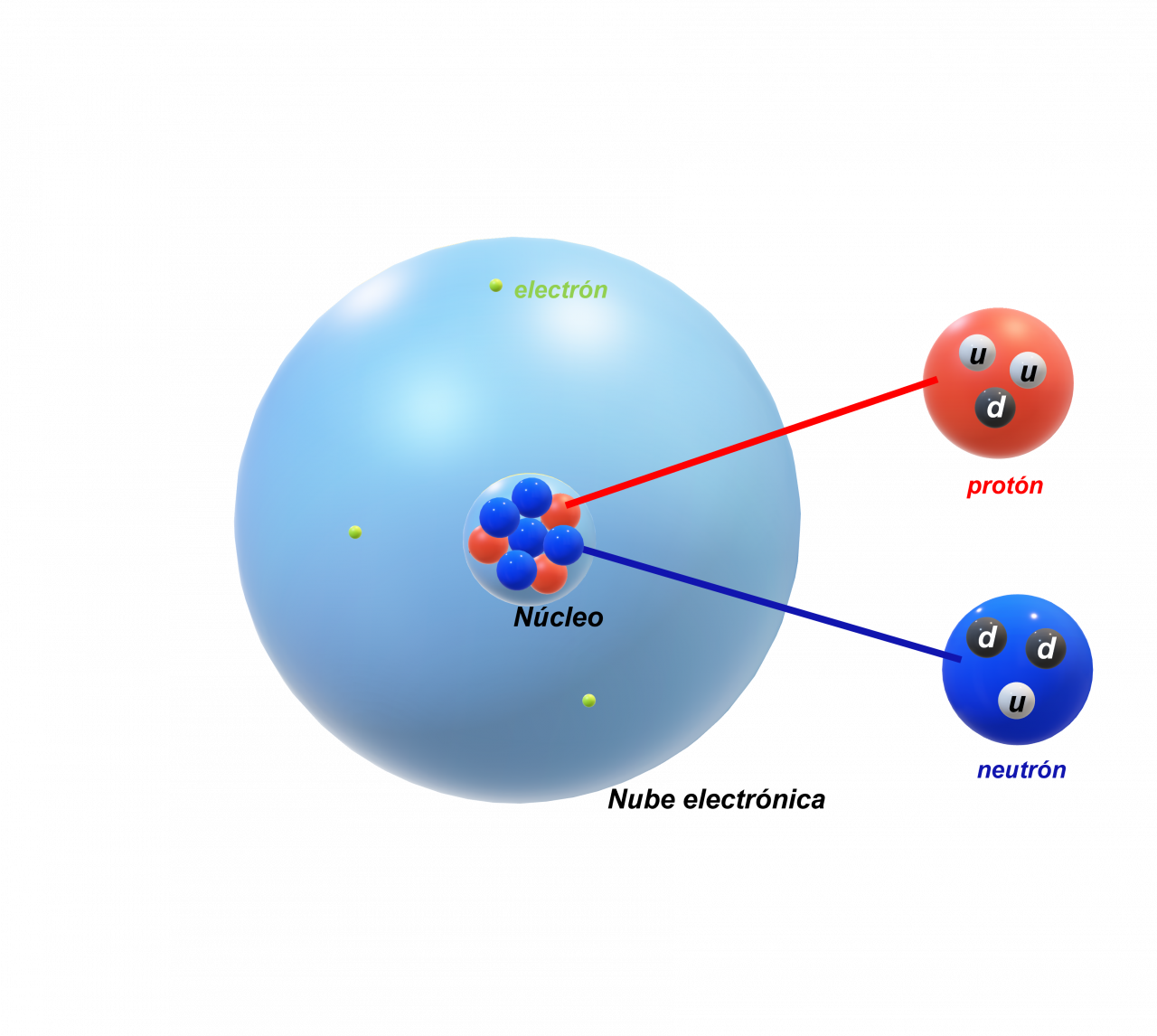
NÚMERO ATÓMICO (Z)
El número de protones se denomina número atómico. Todos los átomos de un elemento tienen el mismo número de protones en el núcleo. Pero el número específico de protones es diferente para cada distinto elemento, dado que un átomo no tiene carga eléctrica neta, el número de electrones que contiene debe ser igual al número de protones. Por ejemplo, todos los átomos del elemento carbono tienen seis protones y seis electrones.
NÚMERO MÁSICO (A)
Es el número total de protones más neutrones en el átomo. Por ejemplo, átomos de carbono contienen seis protones y seis neutrones, y por tanto su masa atómica es de 12 y se representa como 12C.
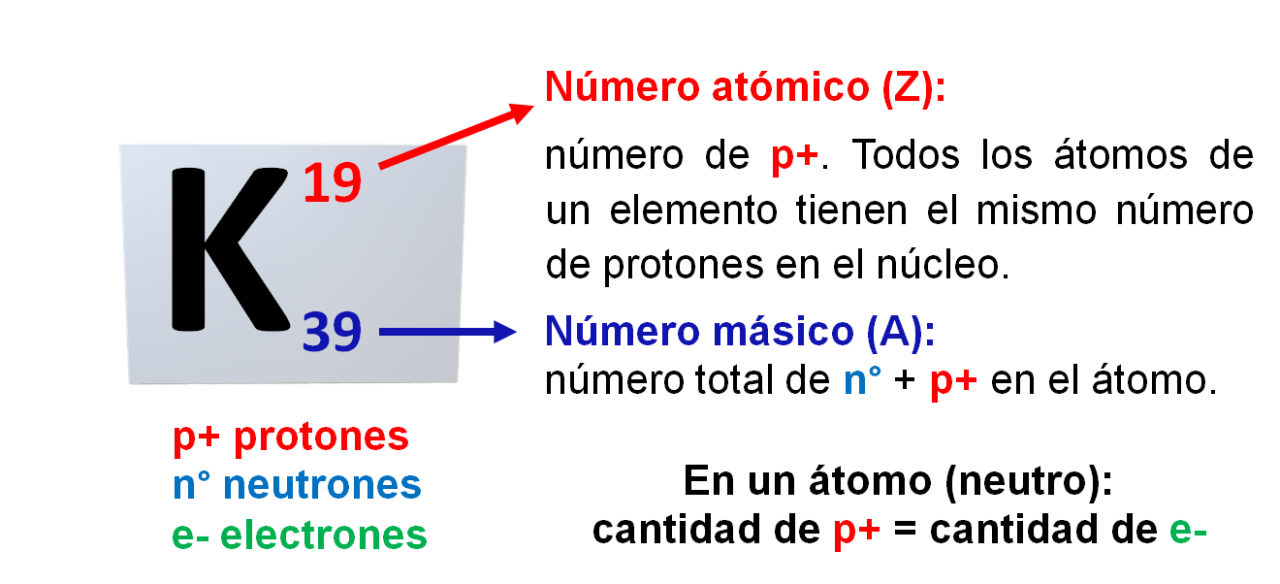
IONES
Iones: el núcleo de un átomo no cambia en los procesos químicos ordinarios, pero los átomos pueden adquirir o perder electrones fácilmente. Si a un átomo neutro pierde o gana electrones, se forma una partícula cargada llamada ion. Un ion con carga positiva se denomina catión; uno con carga negativa es un anión. Por ejemplo, el átomo de sodio, que tiene 11 protones y 11 electrones, pierde con facilidad un electrón. El catión resultante tiene 11 protones y 10 electrones, por tanto, tiene una carga neta de 1+. La carga neta de un ion se representa con un superíndice como Na+. En el caso del cloro con 17 protones y 17 electrones, a menudo gana un electrón en las reacciones químicas, para producir el ion Cl-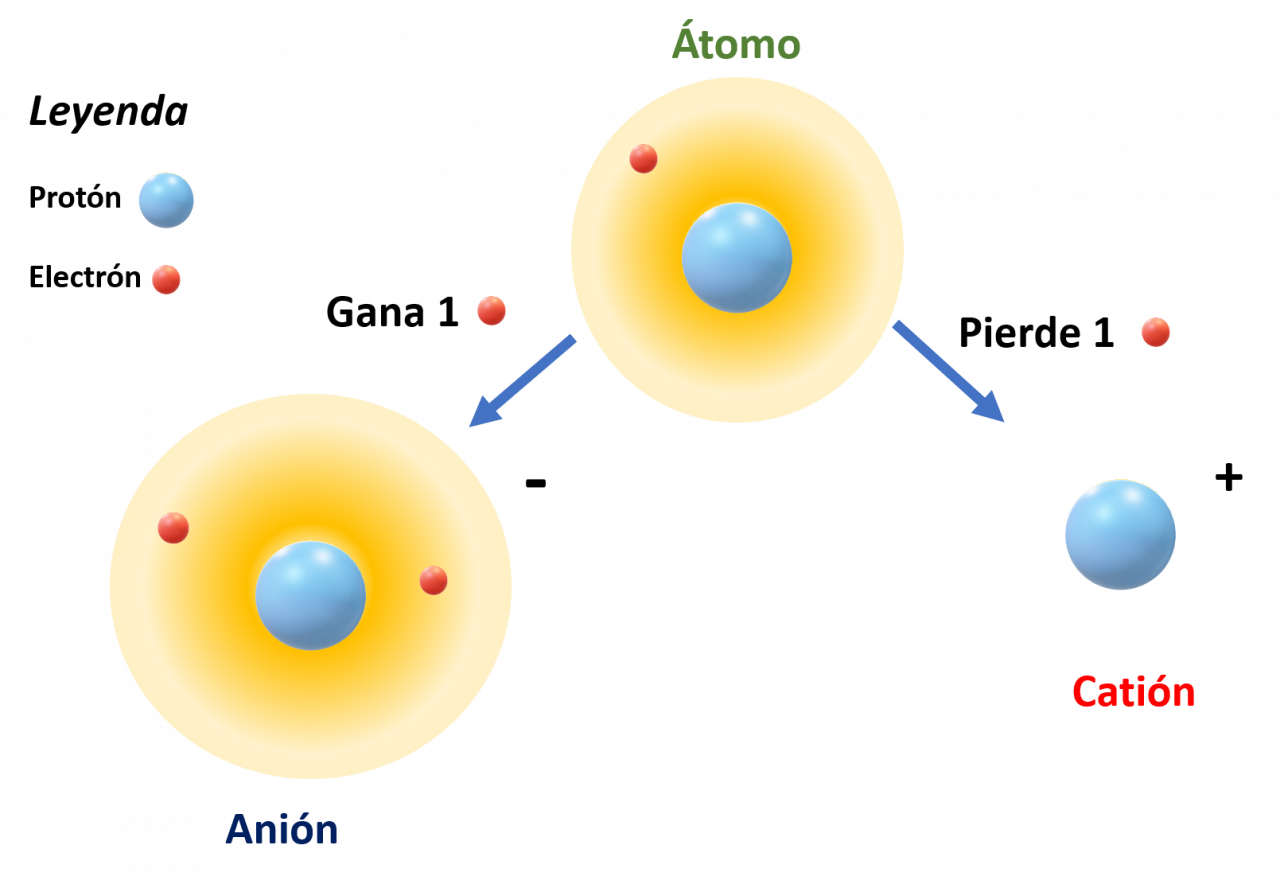
ISÓTOPOS
Son átomos de un elemento dado que difieren en el número de neutrones, y por tanto en su masa. La mayor parte de los átomos de carbono tiene seis neutrones, aunque algunos tienen más y otros tienen menos. Por ejemplo se muestra un esquema de los isótopos de hidrógeno: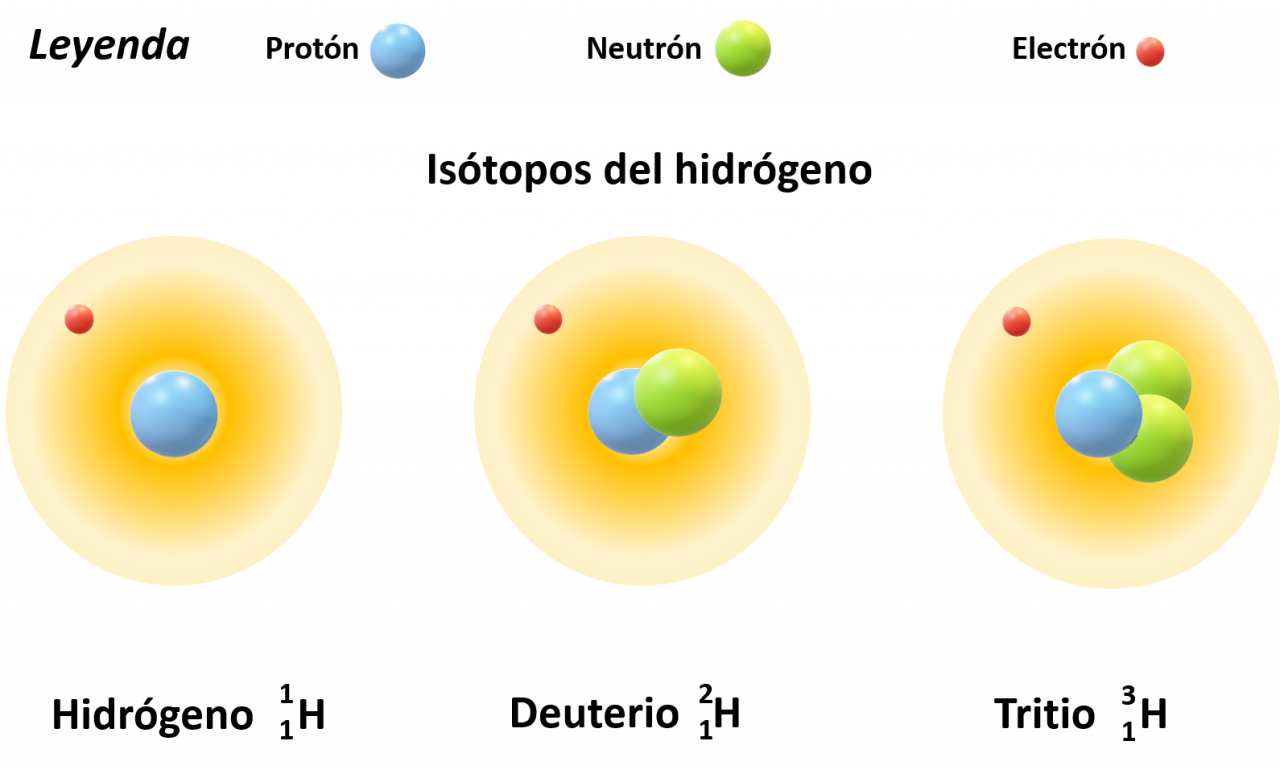
Otros ejemplos de isótopos con carbono 12 6 C, 13 6 C y 14 6 C.
PESOS ATÓMICOS Y MASA ATÓMICA PROMEDIO
La mayor parte de los elementos se dan en la naturaleza como mezclas de isótopos. Se puede determinar la masa atómica promedio de un elemento a partir de las masas de sus diversos isótopos y de sus abundancias relativas. Por ejemplo, el carbono natural se compone de un 98.93% de 12C y de 1.07% de 13C.
Las masas de estos isótopos son 12 uma (exactamente) y 13.00335 uma, respectivamente. Calculamos la masa atómica promedio del carbono a partir de la abundancia fraccionaria de cada isótopo y la masa de ese isótopo:
(0,9893) (12 uma) + (0,0107) (13,00335 uma) = 12,01 uma
La masa atómica promedio de cada elemento (expresada en uma (unidad de masa atómica)) también se denomina peso atómico. A pesar de que el término masa atómica promedio es más correcto, y a menudo se usa el término más sencillo de masa atómica, el uso del término peso atómico es lo más común.
A continuación se muestra un ejercicio de encontrar las partículas subatómicas para la especie:
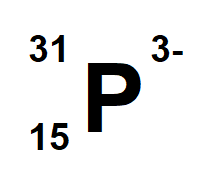
El número atómico Z= 15, por lo tanto la especie tiene 15 protones.
Su número másico A es igual a 31, por lo que al restar A-Z se tiene la cantidad de neutrones:
31-15 = 16 neutrones
La especie neutra, es decir un átomo de fósforo tiene la misma cantidad de electrones, es decir 15 electrones, sin embargo lo que se representa en el ejemplo es un anión del fósforo que ha ganado 3 electrones más, por lo que la cantidad de electrones es de 18, por lo tanto su carga eléctrica será de 3-.
Otros ejemplos:
Ejercicio para resolver
Complete el siguiente cuadro: